ФАРАДЕЯ ЗАКОНЫ
, основные
законы электролиза
, отражающие общий закон сохранения в-ва в условиях
протекания злектрохим. р-ции. Установлены M. Фарадеем в 1833-34. Согласно 1-му
закону, масса в-ва т, прореагировавшего в процессе электролиза, прямо
пропорциональна силе тока I и времени электролиза t, т.
е. кол-ву пропущенного электричества Q = It (предполагается, что I
не зависит от t; в противном случае
масса т пропорциональна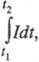 где t1 и t2 - моменты включения
и выключения тока). Согласно 2-му закону, для разных электродных процессов при
одинаковом кол-ве пропущенного электричества Q массы прореагировавших
в-в относятся друг к другу так же, как эквиваленты химические
этих в-в.
Оба Ф. з. объединяются одним ур-нием:
где t1 и t2 - моменты включения
и выключения тока). Согласно 2-му закону, для разных электродных процессов при
одинаковом кол-ве пропущенного электричества Q массы прореагировавших
в-в относятся друг к другу так же, как эквиваленты химические
этих в-в.
Оба Ф. з. объединяются одним ур-нием:
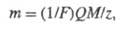
где M -
мол. м.
в-ва, участвующего в электролизе, z - число элементарных зарядов, соответствующее
превращению одной молекулы этого в-ва, 1/F- коэф. пропорциональности,
общий для всех в-в, F - Фарадея постоянная
, равная 96484,56 Кл/моль.
Ф. з. относятся к числу
строгих законов, но в ряде случаев могут наблюдаться кажущиеся отклонения от
них, вызываемые след. причинами: 1) в нестационарных условиях электролиза часть
электричества затрачивается на заряжение двойного электрического слоя
; 2)
если электролит обладает электронной проводимостью (напр., р-р металлич. Na
в жидком аммиаке), то часть тока через электролит переносят электроны, а не
ионы, и соответствующее кол-во электричества не участвует в процессе электролиза;
3) наряду с основным процессом электролиза, напр, образованием металлич. Zn
по р-ции Zn2+ + 2е Zn, часть тока может затрачиваться на протекание параллельных электрохим. р-ций,
напр.: 2H3O+ + 2е = H2 + 2H2O; O2
+ 4е + 4H3O+ = 6H2O. Системы, в к-рых полностью
исключены указанные причины кажущихся отклонений от Ф. з., получили назв. кулонометров;
их использование позволяет по кол-ву образовавшихся продуктов электролиза точно
определить кол-во пропущенного электричества. В кулонометрах обычно применяют
электрохим. р-ции Ag+ + е = Ag или 3I- = I3-
+ 2е.
Zn, часть тока может затрачиваться на протекание параллельных электрохим. р-ций,
напр.: 2H3O+ + 2е = H2 + 2H2O; O2
+ 4е + 4H3O+ = 6H2O. Системы, в к-рых полностью
исключены указанные причины кажущихся отклонений от Ф. з., получили назв. кулонометров;
их использование позволяет по кол-ву образовавшихся продуктов электролиза точно
определить кол-во пропущенного электричества. В кулонометрах обычно применяют
электрохим. р-ции Ag+ + е = Ag или 3I- = I3-
+ 2е.
Ф. з. сыграли важную роль
в понимании природы хим. связи и развития атомно-молекулярной теории. Их используют
при выводе всех ур-ний, описывающих электрохим. превращения B-B на границах
раздела проводников 1-го и 2-го рода (см. Электрохимическая кинетика
). Практич.
применение Ф. з. находят в кулонометрии
, а также при определении выхода
р-ции по току, т.е. отношения теоретич. кол-ва электричества, рассчитанного
на основе Ф. з., к кол-ву электричества, реально затраченному на получение данного
в-ва в процессе электролиза.
Лит.: Антропов Л.И.,
Теоретическая электрохимия, 4 изд., M., 1984, с. 278-86. Б. Б. Дамаскин.
|

