ФИБРИН
, белок, образующийся
из фибриногена под действием фермента тромбина
; конечный продукт свертывания
крови, структурная основа тромба.
Предшественник Ф. (фибриноген)-
гликопротеин (мол. м. 340 тыс.), содержащий две одинаковые субъединицы, каждая
из к-рых состоит из трех разл. полипептидных цепей А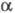 (мол.
м. 67 тыс.), В
(мол.
м. 67 тыс.), В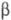 (мол. м. 56 тыс.) и
(мол. м. 56 тыс.) и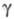 (47
тыс.); ф-ла фибриногена (А
(47
тыс.); ф-ла фибриногена (А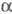 ,
В
,
В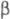 ,
, 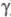 )2
(А и В - N-концевые последовательности соотв.
)2
(А и В - N-концевые последовательности соотв. 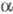 -
и
-
и 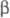 -цепей,
к-рые наз. фибринопептидами А и В).
-цепей,
к-рые наз. фибринопептидами А и В).
В молекуле фибриногена
находится 24 связи S-S, три из к-рых связывают 6 полипептидных цепей в N-концевых
областях, формируя центральный, или E-домен. Два идентичных крайних D-домена
включают С-концевые области 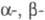 и
и 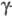 -цепей
(молекула имеет форму гантели).
-цепей
(молекула имеет форму гантели).
Переход фибриногена в Ф.
происходит по схеме:

Активация перехода фибриногена
в Ф. происходит в Е-до-мене, в N-концевых областях А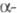 и
В
и
В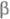 -цепей.
Она начинается с гидролиза тромбином пептидных связей, образованных Arg-15 и
GIy-16 в
-цепей.
Она начинается с гидролиза тромбином пептидных связей, образованных Arg-15 и
GIy-16 в 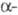 цепи
(букв. обозначения см. в ст. Аминокислоты
). При этом высвобождаются две
молекулы фибри-нопептида А и формируются два участка полимеризации, к-рые спонтанно
взаимод. с комплементарными центрами полимеризации, расположенными в С-концевых
областях D-доменов двух др. молекул. Нековалентное межмол. взаимод. между E-
и D-доменами ведет к образованию двухнитча-того полимера.
цепи
(букв. обозначения см. в ст. Аминокислоты
). При этом высвобождаются две
молекулы фибри-нопептида А и формируются два участка полимеризации, к-рые спонтанно
взаимод. с комплементарными центрами полимеризации, расположенными в С-концевых
областях D-доменов двух др. молекул. Нековалентное межмол. взаимод. между E-
и D-доменами ведет к образованию двухнитча-того полимера.
След. этап активации -
отщепление двух молекул фибри-нопептида В в результате гидролиза тромбином пептидной
связи между остатками Arg-14 и GIy-15 в 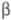 -цепи,
в результате чего формируются два дополнит, участка полимеризации в E-домене
фибрин-мономера, комплементарных двум центрам в D-доменах. Скорость отщепления
фибринопептидов В увеличивается в процессе полимеризации фибрин-мономеров. Растущие
изначально только в длину протофибриллы Ф. начинают утолщаться и ветвиться.
Фибриллы ассоциируются латерально, превращаясь в толстые, скрученные наподобие
спирали волокна трехмерной сети фибринового сгустка.
-цепи,
в результате чего формируются два дополнит, участка полимеризации в E-домене
фибрин-мономера, комплементарных двум центрам в D-доменах. Скорость отщепления
фибринопептидов В увеличивается в процессе полимеризации фибрин-мономеров. Растущие
изначально только в длину протофибриллы Ф. начинают утолщаться и ветвиться.
Фибриллы ассоциируются латерально, превращаясь в толстые, скрученные наподобие
спирали волокна трехмерной сети фибринового сгустка.
Структура фибринового сгустка
стабилизируется транспеп-тидазой, или фактором ХШа, к-рый в присут. Ca2+
катализирует образование поперечных "сшивок" между антипараллельными
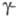 цепями
путем образования ковалентных изопеп-тидных связей между Gln-398 одной цепи
и Lys-406 другой (в результате р-ции трансамидирования). В последующем образуются
изопептидные связи между
цепями
путем образования ковалентных изопеп-тидных связей между Gln-398 одной цепи
и Lys-406 другой (в результате р-ции трансамидирования). В последующем образуются
изопептидные связи между 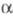 -цепями,
в к-рых участвуют остатки Gln-328 и Lys-518, а также Gln-366 и Lys-584 с образованием
-цепями,
в к-рых участвуют остатки Gln-328 и Lys-518, а также Gln-366 и Lys-584 с образованием
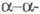 мультимеров,
что обусловливает латеральный рост фибриновых волокон.
мультимеров,
что обусловливает латеральный рост фибриновых волокон.
От структуры фибринового
сгустка и степени его стабилизации зависят мех. св-ва сгустка, такие, как эластичность
и прочность. Это важно для выполнения им гемостатич. ф-ций, поскольку он является
основой гемостатич. тромба, препятствующего истечению крови из сосудов при нарушении
их целостности при разл. рода повреждениях. Генетич. аномалии молекулы фибриногена
и низкая концентрация фактора ХШа в крови приводят к ненормальной полимеризации
и образованию фибринового сгустка с нарушенными физ. св-вами, что ведет к ряду
патологич. состояний, сопровождающихся кровоточивостью или тромботич. осложнениями
у больных.
Ф. является также прир.
субстратом плазмина
, к-рый регулирует процесс фибринолиза, приводящий
к растворению фибриновых сгустков и тромбов. Высокое сродство Ф. к предшественнику
плазмина (плазминогену) и его тканевому активатору обеспечивает возможность
образования плазмина непосредственно на пов-сти полимерного фибрина, или тромба.
Лит.: Овчинников
Ю.А., Биоорганическая химия, M., 1987, с. 234-36; Медведь Л.В., Литвинович СВ.,
"Биохимия животных и человека", 1989, № 13, с. 18-27; Позднякова
T. M., там же, с. 27-36.
И. П. Баскова.
|

