ХРОМА ГАЛОГЕНИДЫ
.
Дифторид
CrF2 при давлении 2,7 ГПа превращается в ромбич. модификацию,
при 27-29 ГПа - в тетрагональную (табл.); плохо раств. в воде, не раств.
в этаноле, медленно реагирует с минеральными к-тами; на воздухе окисляется;
с фторидами щелочных металлов образует комплексы MCrF3 и M2CrF4.
Трифторид CrF3 не раств. в воде, этаноле, р-рах NH3,
плохо раств. в к-тах, при нагр. на воздухе превращается в Сr2О2,
водяным паром гидролизуется выше ~ 500 °С; с фторидами щелочных металлов
при сплавлении образует M3CrF6 и M5Cr3F14
зеленого цвета; ферримагнетик. Ниже 15 °С устойчив нонагидрат CrF3
х 9H2O (фиолетовый), р-римость в воде 0,9%
при 0 °С, легко обезвоживается до гексагидрата (фиолетовый, плохо раств.
в воде). Выше 20 °С из водных р-ров кристаллизуется зеленый тригидрат CrF3
х 3H2O, его р-римость в воде 3,46% по массе
при 20 °С, р-ры склонны к пересышению. Не р-римый в воле тригидрад, для
к-рого предложена ф-ла [Cr(H2O)6]CrF6,
образуется при нагр. гексагидрата при 60-70 °С. Получают CrF3
взаимод. гидроксида или солей Сr(III) с плавиковой к-той, восстановлением
СrО3 в р-ре HF, напр, этанолом; протрава при крашении тканей,
пигмент.
Тетрафторид CrF4 - коричневое
аморфное в-во; т. пл. 277 °С, т. возг. 295 °С; плотн. 2,90 г/см3;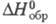 -1200 кДж/моль; при действии воды диссоциирует на соед. Сr(III) и Cr(IV),
разъедает стекло, образует с щелочными металлами соед. типа M2CrF6;
образуется при фторировании порошка Сr. При фторировании под давлением
получают пентафторид CrF5 и лимонно-желтый гексафторид CrF6,
к-рый легко диспропорционирует в вакууме уже при 100 °С. Диоксидифторид
хрома (хромилфторид) CrO2F2 на свету медленно полимеризуется,
превращаясь в серое в-во с т. пл. ~ 200 °С; водой легко гидролизуется;
разрушает стекло, кварц, бурно окисляет орг. в-ва; с хроматами образует
фторохроматы, напр. KCrO3F; получают при натр. К2Сr2О7
с дымящей H2SO4 и CaF2; реагент в орг.
и неорг. синтезе.
-1200 кДж/моль; при действии воды диссоциирует на соед. Сr(III) и Cr(IV),
разъедает стекло, образует с щелочными металлами соед. типа M2CrF6;
образуется при фторировании порошка Сr. При фторировании под давлением
получают пентафторид CrF5 и лимонно-желтый гексафторид CrF6,
к-рый легко диспропорционирует в вакууме уже при 100 °С. Диоксидифторид
хрома (хромилфторид) CrO2F2 на свету медленно полимеризуется,
превращаясь в серое в-во с т. пл. ~ 200 °С; водой легко гидролизуется;
разрушает стекло, кварц, бурно окисляет орг. в-ва; с хроматами образует
фторохроматы, напр. KCrO3F; получают при натр. К2Сr2О7
с дымящей H2SO4 и CaF2; реагент в орг.
и неорг. синтезе.
Дихлорид СrС12 относительно
устойчив в сухом воздухе, с О2 начинает реагировать при ~ 900
°С, быстро увлажняется и окисляется в присуг. паров воды; из водных р-ров
(голубых) кристаллизуются кристаллогидраты: до 38 °С - темно-синий тетрагидрат,
в интервале 38-51 °С - его темно-зеленая модификация, при 51-83 °С - бледно-голубой
тригидрат, выше 83 °С - бледно-зеленый дигидрат, к-рый обезвоживается при
113 °С. СrС12 мало раств. в этаноле, не раств. в эфире, с хлоридами
щелочных металлов образует соед. типов М3СrС15, МСrС13,
М2СrС14; получают действием НС1 на Сr или Н2
на СгС13 при 600-700 °С; используют для получения Сr высокой
чистоты, как реагент в аналит. химии.
СВОЙСТВА ГАЛОГЕНИДОВ И ОКСОГАЛОГЕНИДОВ
ХРОМА
|
Показатель
|
CrF2
|
CrF3
|
CrF6
|
CrO2F2
|
СrСl2
|
СrС13
|
СгВг2
|
СгВг,
|
СИ2
|
Crf,
|
|
Цвет
|
Синевато-зеленый
|
Зеленоватый
|
Огненно-красный
|
Фиолетово-красный
|
Бесцв.
|
Красно-фиолетовый
|
Бесцв.
|
Темно-зеленый,
черный
|
Коричнево-красный;
бледно-серый
|
Черный
|
|
Сингония
|
Моноклинная
|
Тритон.
|
Ромбич.
|
Моноклинная
|
Ромбич.
|
Моноклинная
|
Моноклинная
|
Тритон.
|
Ромбич.
|
Тригон.
|
|
Параметры ячейки:
а, им
|
0,4732
|
0,602
|
0,55
|
0,568
|
0,665
|
0,5959
|
0,7111
|
0,6308
|
0,3915
|
0,6859
|
|
b, нм
|
0,4718
|
_
|
0,74
|
0,492
|
0,599
|
1,0321
|
0,3649
|
_
|
0,7560
|
_
|
|
с, нм
|
0,3505
|
1,73
|
1,63
|
0,904
|
0,348
|
0,6114
|
0,6217
|
1,835
|
1,3553
|
1,988
|
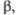
град |
96,52
|
—
|
—
|
93
|
—
|
108,48
|
93,88
|
—
|
—
|
—
|
|
z
|
2
|
6
|
8
|
4
|
2
|
_
|
2
|
6
|
4
|
6
|
|
Пространств.
группа
|
Р21/с
|
|
Ртсп
|
Р21/С
|
Рпnm
|
С2/т
|
—
|
R3
|
Cmc21
|
Р3212
|
|
Т. пл., °С
|
894
|
1100
|
102
|
31,6
|
824
|
1152
|
842
|
—
|
856
|
857
|
|
Т. кип., °С
|
1820
|
1400
|
117
|
29,6*
|
1330
|
947*
|
—
|
800*
|
1248
|
—
|
|
Плотн., г/см3
|
4,11
|
3,78
|
—
|
3,21
|
2,88
|
3,03
|
4,36
|
4,25
|
5,20
|
4,92
|
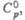
Дж/(моль x К) |
59
|
79
|
—
|
|
71
|
92
|
—
|
96
|
|
|
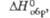
кДж/моль |
-775
|
-1159
|
-1466
|
-880
|
-396
|
-570
|
-298
|
-400
|
-157
|
-205
|
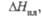
кДж/моль |
19
|
42
|
19,3
|
25,9
|
37
|
—
|
—
|
—
|
—
|
—
|
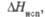
кДж/моль |
251
|
201
|
35,6
|
60,5**
|
198
|
288**
|
—
|
—
|
—
|
—
|
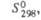
Дж/(моль x К) |
86
|
94
|
209
|
—
|
116
|
125
|
134
|
150
|
154
|
—
|
*Т. возг. **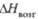
Трихлорид СrС13 известен также
в тригон. модификации; антиферромагнетик; начинает реагировать с О2
при 350 °С, с Н2 - при 515 °С, восстанавливаясь до СrС12,
а выше 700 °С - до Сr; не раств. в воде, в присут. восстановителей (СrС12)
раств. хорошо, давая темно-зеленые р-ры. Из водных р-ров ниже 30 °С кристаллизуется
декагидрат (темно-зеленый), выше 30 °С - гексагидрат, для к-рого известны
4 изомерные формы. При обезвоживании гексагидрата получают коричневый тригидрат,
фиолетовый дигидрат и красные СrС13 x 1,5Н2О и СrС13
x 0,5Н2О. Полное обезвоживание сопровождается гидролизом.
При сплавлении с хлоридами щелочных металлов СrС13 образует
хлорохроматы преим. типов М3СrС16 и М3Сr2С19.
Получают СrС13 хлорированием
Сr2О3, хромита или феррохрома в присут. восстановителей
при 600-800 °С. Используют для хромирования стальных изделий, для получения
Сr. Кристаллогидрат получают растворением Сr(ОН)3 в соляной
к-те или восстановлением р-ров СrО3 в соляной к-те формалином;
применяют как протраву при крашении, компонент электролитов, для получения
др. соед. Сr.
Тетрахлорид СrС14 устойчив
только в парах, м. б. сконденсирован при резком охлаждении, но разлагается
уже при -80 °С.
Из оксохлоридов Сr наиб. важен хромилхлорид
СrО2С12 - вишнево-красная жидкость; т. пл. -96 °С;
т. кип. 116 С;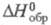 -570,3 кДж/моль; дымит на воздухе, под действием света разлагается с выделением
С12; сильный окислитель и хлорирующий агент; со мн. орг. в-вами
реагирует со взрывом; бурно разлагается водой с образованием Н2СrO4
и НС1; раств. в ССl4, СНС13, CS2, бензоле,
хорошо растворяет С12; горит в сухом NH3; получают
взаимод. СrО3 с конц. соляной к-той и H2SO4
или действием H2SO4 на смесь K2Cr2O7
+ NaCl; реагент в орг. синтезе, при получении комплексов Сr.
-570,3 кДж/моль; дымит на воздухе, под действием света разлагается с выделением
С12; сильный окислитель и хлорирующий агент; со мн. орг. в-вами
реагирует со взрывом; бурно разлагается водой с образованием Н2СrO4
и НС1; раств. в ССl4, СНС13, CS2, бензоле,
хорошо растворяет С12; горит в сухом NH3; получают
взаимод. СrО3 с конц. соляной к-той и H2SO4
или действием H2SO4 на смесь K2Cr2O7
+ NaCl; реагент в орг. синтезе, при получении комплексов Сr.
Дибромид СrВr2 быстро окисляется
на воздухе, в отсутствие О2 дает голубые водные р-ры, образует
гексагидрат; получают восстановлением СrВr3 водородом и др.
Трибромид СrВr3 при нагр. окисляется, медленно раств. в горячей
воде, быстро - в присут. восстановителей; известно неск. форм гексагидрата;
получают взаимод. паров Вr2 с порошком Сr.
Дниодид CrI2 хорошо раств.
в воде в отсутствие О2 (голубые р-ры), образует гексагидрат;
получают взаимод. Сr с I2; пигмент для стекла. Трииодид CrI3
при натр, отщепляет I2, с трудом раств. в воде, легко - в присут.
CrI2, из р-ров кристаллизуется темно-фиолетовый гексагидрат;
получают из простых в-в. Иодиды Сr - промежут. продукты при иодидном рафинировании
Сr.
П. И. Федоров.



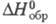 -1200 кДж/моль; при действии воды диссоциирует на соед. Сr(III) и Cr(IV),
разъедает стекло, образует с щелочными металлами соед. типа M2CrF6;
образуется при фторировании порошка Сr. При фторировании под давлением
получают пентафторид CrF5 и лимонно-желтый гексафторид CrF6,
к-рый легко диспропорционирует в вакууме уже при 100 °С. Диоксидифторид
хрома (хромилфторид) CrO2F2 на свету медленно полимеризуется,
превращаясь в серое в-во с т. пл. ~ 200 °С; водой легко гидролизуется;
разрушает стекло, кварц, бурно окисляет орг. в-ва; с хроматами образует
фторохроматы, напр. KCrO3F; получают при натр. К2Сr2О7
с дымящей H2SO4 и CaF2; реагент в орг.
и неорг. синтезе.
-1200 кДж/моль; при действии воды диссоциирует на соед. Сr(III) и Cr(IV),
разъедает стекло, образует с щелочными металлами соед. типа M2CrF6;
образуется при фторировании порошка Сr. При фторировании под давлением
получают пентафторид CrF5 и лимонно-желтый гексафторид CrF6,
к-рый легко диспропорционирует в вакууме уже при 100 °С. Диоксидифторид
хрома (хромилфторид) CrO2F2 на свету медленно полимеризуется,
превращаясь в серое в-во с т. пл. ~ 200 °С; водой легко гидролизуется;
разрушает стекло, кварц, бурно окисляет орг. в-ва; с хроматами образует
фторохроматы, напр. KCrO3F; получают при натр. К2Сr2О7
с дымящей H2SO4 и CaF2; реагент в орг.
и неорг. синтезе.
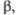 град
град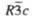
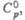 Дж/(моль x К)
Дж/(моль x К)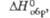 кДж/моль
кДж/моль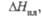 кДж/моль
кДж/моль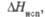 кДж/моль
кДж/моль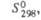 Дж/(моль x К)
Дж/(моль x К)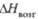
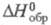 -570,3 кДж/моль; дымит на воздухе, под действием света разлагается с выделением
С12; сильный окислитель и хлорирующий агент; со мн. орг. в-вами
реагирует со взрывом; бурно разлагается водой с образованием Н2СrO4
и НС1; раств. в ССl4, СНС13, CS2, бензоле,
хорошо растворяет С12; горит в сухом NH3; получают
взаимод. СrО3 с конц. соляной к-той и H2SO4
или действием H2SO4 на смесь K2Cr2O7
+ NaCl; реагент в орг. синтезе, при получении комплексов Сr.
-570,3 кДж/моль; дымит на воздухе, под действием света разлагается с выделением
С12; сильный окислитель и хлорирующий агент; со мн. орг. в-вами
реагирует со взрывом; бурно разлагается водой с образованием Н2СrO4
и НС1; раств. в ССl4, СНС13, CS2, бензоле,
хорошо растворяет С12; горит в сухом NH3; получают
взаимод. СrО3 с конц. соляной к-той и H2SO4
или действием H2SO4 на смесь K2Cr2O7
+ NaCl; реагент в орг. синтезе, при получении комплексов Сr.