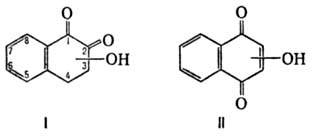
ОКСИНАФТОХИНОНЫ
(гидроксинафтохиноны),
производные нафтохинонов, содержащие в молекуле одну или неск. гидроксильных
групп.
Все О.-кристаллы от желтого
до темно-красного цвета (см. табл.); хорошо раств. в полярных орг. р-рителях
(особенно моногидроксипроизводные ф-л I и II) и водных р-рах щелочей. Нек-рые
О. нестабильны и не имеют четких т-р плавления, поэтому их идентифицируют в
виде ацетильных или алкоксильных производных, а также продуктов р-ции с 1,2-фенилендиамином
- феназинов.
О., содержащие гидроксигруппы
в сопряженном арома-тич. ядре, обладают св-вами фенолов
и нафтохинонов
.
О., имеющие гидроксигруппы в положениях 5 или 8, проявляют пери
-таутомерию
вследствие образования прочной водородной связи, О. с гидроксильными группами
в хиноидной системе - орто-пара-таутомерию:
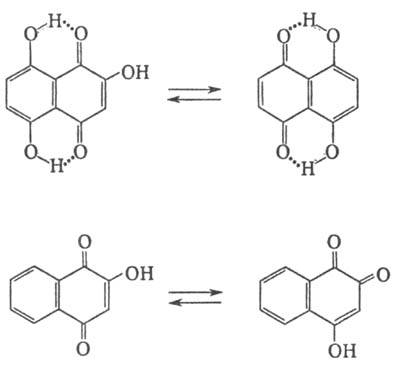
2-Гидрокси-1,4-нафтохинон-к-та,
рКа 4,0 (25 °С, вода); в р-рах изомеризуется в 4-гидрокси-1,2-нафтохинон.
Под действием СН3I, С2Н5I или С4Н9I
превращ. в 4-алкокси-1,2-нафтохиноны с примесью 2-алкокси-1,4-нафтохинонов,
под действием (СН3)2СНI, СН3ОН (в 3%-ном р-ре
НСl) или CH2N2-
в соответствующие 2-алкокси-1,4-нафтохиноны. При нагр. с тетрадециламином (кат.-HCl)
замещает гид-роксил на аминогруппу с образованием 2-тетрадецилами-но-1,4-нафтохинона;
вступает в р-цию Манниха; по положению 3 нитруется смесью HNO3 и
H2SO4, галогенирует-ся в присут. СН3СООН, реагирует
с солями арилдиа-зония; вступает в диеновый синтез с 1,3-бутадиеном (С2Н5ОН,
135-140 °С); окисляется О2 в присут. КОН в антрахинон.
5-Гидрокси-1,4-нафтохинон
легко раств. в СНСl3, разб. р-рах щелочей, плохо-в холодном этаноле,
диэтиловом эфире. По хим. св-вам аналогичен 1,4-нафтохинону; присоединяет галогены
по положениям 2 и 3, окисляется щелочным р-ром Н2О2 в
3-гидроксифталевую к-ту.
6-Гидрокси-1,4-нафтохинон
нитруется 66%-ной HNO3 в СН3СООН до 5-нитропроизводного,
присоединяет Вr2 в СН3СООН по положениям 2 и 3.
Выделяют 2-гидрокси-1,4-нафтохинон
из листьев лавсо-нии (Lawsonia alba) действием р-ра соды (60 °С) с послед.
подкислением НСl. Пром. методы получения: окисление пероксидом водорода 1-нафтола
(кат.-ортованадаты щелочных металлов) или 1,2-нафтохинона (в р-ре КОН); окисление
действием О2 воздуха 1,3-дигидроксинафталина (кат.-КОН); окисление
2-нафтола системой СН3ОН-мор-фолин-соль Сu (II).
5-Гидрокси-1,4-нафтохинон
выделяют из зеленой скорлупы грецких орехов Juglaus regia; синтезируют окислением
1,5-дигидроксинафталина дихроматом Na в H2SO4.
СВОЙСТВА НЕКОТОРЫХ ГИДРОКСИНАФТОХИНОНОВ
|
|
|
|
|
|
|
|
|
|
Положения групп
ОН в ядре
|
|
|
|
Т.пл. нек-рых производных,
|
|
|
|
|
Моногидрокси-1,
2-нафтохиноны
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Моногидрокси-1,4-нафтохиноны
|
|
|
|
|
Лавсон (нафталиновая
к-та)*
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
102 (ацетильное
производное)
|
|
|
|
|
Дигидрокси-1,4-нафтохиноны
|
|
|
|
|
|
|
|
105-106 (диацетильное
производное)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
163 (диацетильное
производное)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
152 (диацетильное
производное)
|
|
|
|
|
|
|
|
152 (с разл.; диацетильное
производное)
|
|
|
|
|
|
|
|
126-127 (диацетильное
производное)
|
|
|
|
|
|
|
|
195-196 (диацетильное
производное)
|
|
|
|
|
|
|
|
65-67 (диацетильное
производное)
|
|
|
|
|
Полигидрокси-1,4-нафтохиноны
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
165-166 (триацетильное
производное)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
157 (тетраацетильное
производное)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* рКа 4,00
(25°С, вода). ** pKa1 8,2, рКa2
10,6 (20°С, вода), 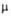 1,60·10-30
Кл·м. *** рКа
5,80 (20 °С, вода).
1,60·10-30
Кл·м. *** рКа
5,80 (20 °С, вода).
4-,5-,6-,7-Гидрокси-1,2-нафтохиноны,
5- и 6-гидрокси-1,4-нафтохиноны получают также окислением соотв. 1,3-, 1,5-,
2,6-, 1,2-, 1,8- и 1,6-дигидроксинафтохинонов солью Фреми [(KOSO2)2NO]
или окислением соответствующих амино-нафталиндиолов Na2Cr2O7
в H2SO4 (О °С) или РеСl3 в разб. НСl (20
°С).
2,3-Дигидрокси-1,4-нафтохинон
получают окислением 1,2-нафтохинона НСlО в воде; 5,8-дигидрокси-1,4-нафтохи-нон
- конденсацией гидрохинона с малеиновым ангидридом при 200-220 °С (кат.-плав
АlСl3 с NaCl).
5,6,8-Тригидрокси-1,4-нафтохинон
синтезируют взаимод. 1,2,4-триметоксибензола с малеиновым ангидридом при 200-250
°С (кат.-АlСl3) или окислением 5,6-дигидрокси-1,4-нафтохинона
О2 воздуха в водном р-ре NaOH.
О.-сильные окислители;
окислит.-восстановит, потенциал для 2-метокси-1,4-нафтохинона составляет 0,353
В, для 2-гидрокси-1,4-нафтохинона 0,362 В, для 5-гидрокси-1,4-наф-тохинона 0,452
В, для 2,3-дигидрокси-1,4-нафтохинона 0,298 В, для 5,8-дигидрокси-1,4-нафтохинона
0,256 В.
О.-промежут. продукты в
синтезе кубовых красителей, окислители; 2-гидрокси-1,4-нафтохинон-красящее в-во
хны, используемой в косметике; 5-гидрокси-1,4-нафтохинон-прир. краситель для
шерсти и хлопка, фунгицид, компонент кожных мазей в медицине и ветеринарии;
2-алкил-З-гидро-кси-1,4-нафтохиноны- антималярийные препараты и инсектициды;
5,8-Дигидрокси-1,4-нафтохинон и 5,7,8-тригидро-кси-1,4-нафтохиноны-реактивы
для фотометрич. определения Be и Th.
Лит. см. при ст.
Нафтохиноны
. Н. Б. Карпова.





 1,60·10-30
Кл·м. *** рКа
5,80 (20 °С, вода).
1,60·10-30
Кл·м. *** рКа
5,80 (20 °С, вода).