 |
Реклама |
|
|
 |
* При 1 мм рт. ст. А.о.-более слабые основания, чем исходные амины. Их основные св-ва определяются
отрицат. зарядом на кислороде, по к-рому происходит как присоединение протона,
так и алкилирование. При действии арилгалогенидов образуются соли тетразамещенного
гидроксиаммония, разлагающиеся при обработке щелочью:
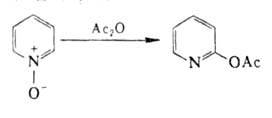
При ацилировании А.о. происходят след. превращения:
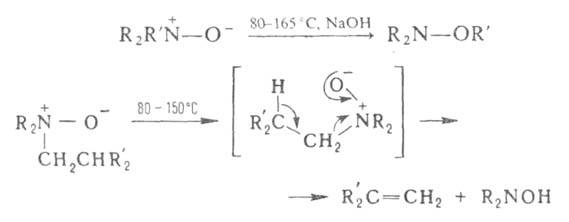
При нагр. алифатич. А. о. образуют замещенные гидроксиламины (перегруппировка
Майзенхаймера) или олефины (перегруппировка Коупа), напр.:
где R - Alk, Ar; R = СН2С6Н5, СН(С6Н5)2, СН2СН=СН2. А. о. восстанавливаются до аминов гидрированием на Ni или Pd, а также
действием производных трехвалентного фосфора, напр. (С6Н5bР-
В N-Оксиды пиридина и его гомологов, производных хинолина нитруются до 4-нитропроизводных. При р-ции с РОС13, РС15, SOC12 образуются 1- и 4-хлорпроизводные, с ангидридами и галогенангидридами к-т-2-ацилоксипроизводные с металлоорг. соед.-2-алкилпроизводные, с анионом CN- в присут. хлористого бензоила-4-цианпиридин. Общий метод получения А.о.-окисление третичных аминов действием Н2О2
в нейтральной (алифатич. амины) или кислой (ароматич. амины) средах, реже
- озоном или надкислотами (азотистые гетероциклы). Применяется также исчерпывающее
алкилирование гидроксиламина и его производных, циклизация нитро- и нитрозосоединений.
Методы анализа А. о. основаны на восстановлении группы Алифатич. А.о.-ПАВ в космети-ке и парфюмерии, коагулирующие и желатинизирующие агенты, ингибиторы полимеризации, р-рители целлюлозы. Нек-рые А. о. обладают противомикробной и противогрибковой активностью. Лит.: Иоффе Д.В., ЭфросЛ.С, "Успехи химии", 1961, т. 30, в. 11.
с. 1325-51; Общая органическая химия, пер. с англ., т. 3, М., 1982, с.
247-51; Katritzky A.R., Lagowski J.M., Chemistry of the heterocyclic N-oxides,
L.-N.Y.. 1971. Д.В.Иоффе.
|

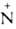 —О-.
Большинство хорошо раств. в воде, ограниченно-в неполярных орг. р-рителях.
Образуют с к-тами устойчивые кристаллич. соли
—О-.
Большинство хорошо раств. в воде, ограниченно-в неполярных орг. р-рителях.
Образуют с к-тами устойчивые кристаллич. соли
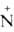 OHX-.
Расположение четырех заместителей у атома азота тетраэдрическое.
OHX-.
Расположение четырех заместителей у атома азота тетраэдрическое.
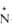 -O-212,0
-O-212,0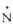 -O
-O
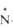 -O-65,6
-O-65,6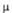 *10-30, Кл-м
*10-30, Кл-м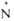 ->O-),
см-1
->O-),
см-1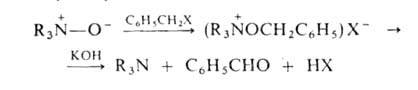
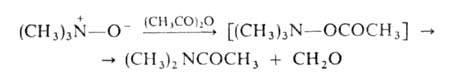
 электронной
системе цикла гетероциклич. А. о. группа
электронной
системе цикла гетероциклич. А. о. группа —О-
может играть роль как донора, так и акцептора электронов. Поэтому А. о.
такого типа вступают в р-ции электроф. и нуклеоф. замещения легче, чем
соответствующие амины. Ацилирование гетероциклич. А. о. происходит след.
образом:
—О-
может играть роль как донора, так и акцептора электронов. Поэтому А. о.
такого типа вступают в р-ции электроф. и нуклеоф. замещения легче, чем
соответствующие амины. Ацилирование гетероциклич. А. о. происходит след.
образом:
 —О- (потенциометрия).
—О- (потенциометрия).