ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛ
,
термодинамич.
ф-ция, характеризующая состояние к.-л. заряженного компонента системы в
нек-рой фазе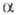 при
определенных внеш. условиях. По определению, Э. п. i-го компонента
(ni - его число молей) равен:
при
определенных внеш. условиях. По определению, Э. п. i-го компонента
(ni - его число молей) равен:
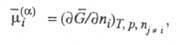
где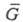 -
электрохим. энергия Гиббса (свободная энергия), учитывающая электрич. поле
внутри фазы
-
электрохим. энергия Гиббса (свободная энергия), учитывающая электрич. поле
внутри фазы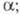 nj
- число молей разл. компонентов j этой фазы;
Т - т-ра; р -
давление.
nj
- число молей разл. компонентов j этой фазы;
Т - т-ра; р -
давление.
Э. п. определяют также как умноженную
на число Авогадро работу переноса заряженной частицы i из бесконечно
удаленной точки в вакууме в данную фазу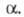 Формально Э. п. разбивают на два слагаемых, характеризующих хим. и электрич.
составляющие такой работы:
Формально Э. п. разбивают на два слагаемых, характеризующих хим. и электрич.
составляющие такой работы:
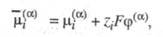
где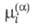 -
хим. потенциал частиц i в фазе
-
хим. потенциал частиц i в фазе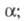 zi
- зарядовое число
этих частиц;
zi
- зарядовое число
этих частиц;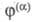 -
внутр. потенциал фазы
-
внутр. потенциал фазы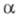 (см. Межфазные скачки потенциала
); F — число Фарадея.
(см. Межфазные скачки потенциала
); F — число Фарадея.
Э. п. входит в соотношения, выражающие
условия электрохим. равновесия. Так, внутри фазы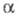 частица i не перемещается, если
частица i не перемещается, если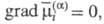 а на границе раздела фаз электрохим. равновесие р-ции vAA +
vBB + vcC+ ...
а на границе раздела фаз электрохим. равновесие р-ции vAA +
vBB + vcC+ ... vLL + vMM + vNN + ... определяется условием:
vLL + vMM + vNN + ... определяется условием:
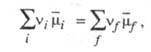
где vi и vf
- стехиометрич. коэф., индекс i указывает исходные компоненты
(А, В, С, ...), а индекс f- конечные (L, М, N, ...).
Лит.: Дамаскин Б.Б., Петрий О. А.,
Электрохимия, М., 1987.
Б. Б. Дамаскин.

